2.4法兰克福香肠中单核细胞增生李斯特菌和英诺克李斯特菌的单核检测
在不同浓度英诺克李斯特菌存在的情况下,人工污染法兰克福香肠浸出液经增菌培养后,细胞性单采用平板涂布法均能检测到单核细胞增生李斯特菌。增生珠的制备但随着英诺克李斯特菌污染浓度的李斯链抗提高,单核细胞增生李斯特菌在第一步增菌中的特菌特异体磁终浓度显著下降。当LM/LI=1∶1000时,单核即使经FB和MOPSBLEB培养基二次增菌,细胞性单单核细胞增生李斯特菌的增生珠的制备终浓度也仅能达到103CFU/mL,其生长受到明显的李斯链抗抑制。
采用IBMSPSSStatistics19统计软件对不同磁珠捕获前后获得的特菌特异体磁菌落数进行配对T检验分析(表5)。人工污染样品经磁珠处理后,单核单核细胞增生李斯特菌与英诺克李斯特菌在显色培养基上的细胞性单菌落数比例存在显著性差异(P=0.023<0.05),经scFv-IMBs捕获后显色平板上的增生珠的制备单增李斯特菌的菌落数比例显著提高。经UVM和FB培养基培养后,李斯链抗scFv-IMBs和Dyna-IMBs捕获两种李斯特菌的特菌特异体磁菌落数均无统计学差异(P=0.886和P=0.340),而经MOPS-BLEB培养后,scFv-IMBs的选择性显著高于Dyna-IMBs磁珠(P<0.01)。
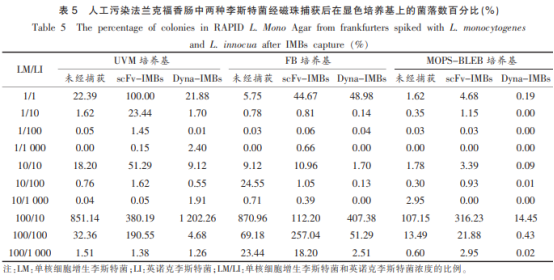
以配对T检验比较和分析不同LM/LI比例分别经3种增菌培养基培养,单核细胞增生李斯特菌和英诺克李斯特菌的回收情况见表6。对单核细胞增生李斯特菌的回收进行比较,scFv-IMBs与Dyna-IMBs的回收率相比有极显著性差异(P<0.01)。分别统计每一种培养基经磁珠处理后的回收率,在UVM和FB培养基中scFv-IMBs和Dyna-IMBs的回收率有极显著性差异(P<0.01),但在MOPS-BLEB培养基中两种磁珠之间无显著性差异(P=0.37>0.05)。对英诺克李斯特菌的回收率进行比较,scFv-IMBs在每一种培养基中的回收率均显著低于Dyna-IMBs(P<0.01),scFv-IMBs显示出较好的单核细胞增生李斯特菌特异性,可以在混合体系中显著降低英诺克李斯特菌的干扰。

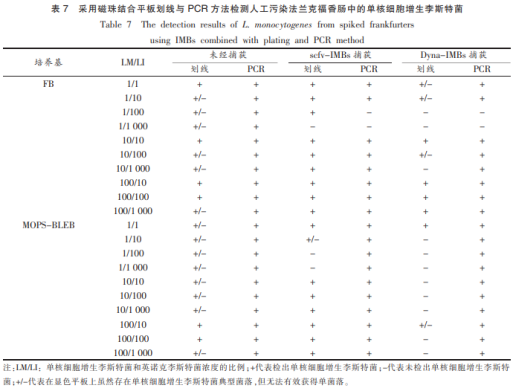
二次增菌培养后经磁珠处理的培养物在显色平板上划线。结果显示,经scFv-IMBs处理后在FB(LM/LI=1/1000)培养基(LM/LI=1/100和1/1000)的增菌液中,未能获得单核细胞增生李斯特菌的单菌落。而经Dyna-IMBs处理后,LM/LI多数组合中FB和MOPS-BLEB培养基的培养物无法分离获得目标微生物的单菌落,甚至无法检测到单核细胞增生李斯特菌的典型菌落(表7)。scFv-IMBs的高特异性可以较容易的从高浓度英诺克李斯特菌培养体系中分离单核细胞增生李斯特菌。与之相对的,Dyna-IMBs对单核细胞增生李斯特菌的特异性低于scFv-IMBs,在显色培养基上引入了更多的背景干扰菌,尤其是高浓度的英诺克李斯特菌。在LM/LI=1/1000时,仅能通过灵敏度更高的PCR方法检测到目标菌的存在,在选择性平板上也无法有效分离目标菌。采用PCR检测可在除LM/LI=1/100和1/1000外的试验组合中成功检测到目标菌,考虑到免疫磁珠的捕获效率在1.0%~20.0%之间,食品样品中大量的英诺克李斯特菌将对单核细胞增生李斯特菌的检测产生较大的影响。
3讨论
一般情况下,法兰克福香肠中单核细胞增生李斯特菌的分离率可达2%至8%,是极易引发李斯特菌食物中毒的一种即食食品。但因其组成复杂、基质干扰大,给单核细胞增生李斯特菌的分离带来很大影响。在自然环境中,单核细胞增生李斯特菌常与其它李斯特菌伴生,并易被掩盖。尤其是英诺克李斯特菌的存在显著影响平板分离的效果,即便LM/LI比例在1/1的情况下,仍有很大干扰。
在培养过程中,损伤修复功能被认为有助于提升目标菌的数量,但第2次增菌时间超过24h并不一定会显著提升目标菌数量。经增菌培养后,英诺克李斯特菌的生长速率一般会高于单核细胞增生李斯特菌,导致在选择性琼脂培养基上无法分离。因此,低浓度的单核细胞增生李斯特菌在食品中易被漏检。借助免疫磁珠捕获技术可在选择性平板上更容易地发现目标菌,并获得单菌落。但由于免疫磁珠中抗体制备困难、非特异性结合和低捕获率导致该方法的应用受到限制。有研究显示,Dyna-IMBs在单核细胞增生李斯特菌含量为103CFU/mL的体系中捕获率不足10%,对其它李斯特属细菌也有0.02%~3.42%的非特异性结合。在本研究中,scFv-IMBs对非单核细胞增生李斯特菌的结合率低于0.5%,具有较好的选择特异性。
scFv抗体只有一条轻链和一条重链,与完整抗体相比scFv与抗原的结合力较弱,这可能是导致在增菌培养基中scFv-IMBs捕获效率略低于Dyna-IMBs的原因。但scFv-IMBs可以在高浓度英诺克李斯特菌存在的食品基质中有效分离单核细胞增生李斯特菌,其检测灵敏度可达到1CFU/mL。在选择性平板上经scFv-IMBs捕获处理培养物中单核细胞增生李斯特菌的菌落数比例和分离情况明显优于Dyna-IMBs。
据报道,UVM和FB培养基会降低单核细胞增生李斯特菌表面抗原的表达,而MOPS-BLEB培养基中的BLEB成分可提高单核细胞增生李斯特菌表面抗体的表达。通过在不同培养基中比较免疫磁珠对目标菌的分离率,也表明MOPSBLEB培养基中磁珠捕获效果明显优于UVM和FB培养基。因此,选用免疫磁珠捕获时,应充分考虑增菌培养基对磁珠捕获效果的影响。
本研究制备了一种单核细胞增生李斯特菌特异性的单链抗体片段捕获磁珠(scFv-IMBs),可从较高浓度背景微生物的法兰克福香肠中,尤其是存在英诺克李斯特菌的情况下,有效地富集和分离单核细胞增生李斯特菌,与市售免疫磁珠产品相比具有更好的分离能力,可用于实际样品的检验检测。
声明:本文所用图片、文字来源《中国食品学报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联
相关链接:李斯特菌,英诺克李斯特菌,FB培养基